ISO 15189 là bộ tiêu chuẩn quốc tế đưa ra các yêu cầu về hệ thống quản lý chất lượng và năng lực chuyên môn dành cho phòng thí nghiệm y tế. Các phòng thí nghiệm y tế rất quan trọng và cần thiết trong việc chăm sóc và điều trị bệnh nhân vì các quyết định điều trị cho bệnh nhân được đưa ra dựa trên kết quả xét nghiệm. ISO 15189 ra đời giúp nâng cao độ tin cậy và đảm bảo kết quả chính xác của phòng xét nghiệm y tế.
Tiêu chuẩn ISO 15189 là gì
ISO 15189 là bộ tiêu chuẩn quốc tế đưa ra các yêu cầu về hệ thống quản lý chất lượng và năng lực chuyên môn dành cho phòng thí nghiệm y tế. Tiêu chuẩn này do Ủy ban kỹ thuật ISO/TC 212 của Tổ chức Tiêu chuẩn hóa Quốc tế (ISO) xây dựng và ban hành, chuyên phụ trách lĩnh vực phòng thí nghiệm y tế và hệ thống chẩn đoán in vitro. ISO 15189 được phát triển dựa trên nền tảng của hai tiêu chuẩn là ISO 9001 và ISO/IEC 17025, đồng thời bổ sung thêm những yêu cầu đặc thù về đảm bảo chất lượng trong hoạt động xét nghiệm y tế.

Các phiên bản của tiêu chuẩn ISO 15189?
Tính đến năm 2024, tiêu chuẩn ISO 15189 đã trải qua bốn lần ban hành và sửa đổi:
Phiên bản đầu tiên (2003): ISO 15189:2003 – quy định yêu cầu về chất lượng và năng lực dành cho phòng thí nghiệm y tế.
Phiên bản thứ hai (2007): ISO 15189:2007 – tiếp tục hoàn thiện các yêu cầu về chất lượng và năng lực trong hoạt động của phòng thí nghiệm y tế.
Phiên bản thứ ba (2012): ISO 15189:2012 – cập nhật và bổ sung các yêu cầu nhằm phù hợp hơn với thực tiễn và công nghệ xét nghiệm y tế.
Phiên bản thứ tư (2022): ISO 15189:2022 – là phiên bản mới nhất, quy định đầy đủ yêu cầu về chất lượng và năng lực, đồng thời thay thế toàn bộ các phiên bản trước.
Hiện nay, chỉ ISO 15189:2022 còn hiệu lực và được áp dụng chính thức trên phạm vi toàn cầu.
Phạm vi áp dụng ISO 15189?
O 15189 được áp dụng cho các phòng xét nghiệm y tế nhằm xây dựng và cải tiến hệ thống quản lý, đồng thời đánh giá năng lực chuyên môn của họ. Tiêu chuẩn này cũng là cơ sở để các cơ quan công nhận, cơ quan quản lý hoặc khách hàng sử dụng dịch vụ xét nghiệm đánh giá và xác nhận năng lực của phòng xét nghiệm. Ngoài ra, ISO 15189 còn có thể áp dụng cho hoạt động xét nghiệm tại chỗ (POCT).

Chứng nhận ISO 15189 có thể áp dụng cho các lĩnh vực sau:
- Hóa sinh lâm sàng – Độc chất – Nội tiết
- Miễn dịch học
- Di truyền học
- Nam học
- Tương thích mô học & di truyền miễn dịch
- Huyết học – Truyền máu
- Vi sinh vật – Virus học – Ký sinh trùng – Huyết thanh học – Nấm học
- Mô bệnh học – Tế bào học – Nhà xác
Lợi ích khi áp dụng tiêu chuẩn ISO 15189
Việc đạt chứng nhận ISO 15189 không chỉ khẳng định uy tín của phòng xét nghiệm y tế, mà còn chứng minh năng lực đáp ứng yêu cầu về chất lượng của khách hàng, cơ quan quản lý và các bên liên quan. Một số lợi ích nổi bật gồm:
Tuân thủ yêu cầu pháp lý
Giúp phòng xét nghiệm đáp ứng các quy định, luật pháp và tiêu chuẩn kỹ thuật liên quan đến lĩnh vực hoạt động.Giảm thiểu rủi ro
Dễ dàng nhận diện các rủi ro tiềm ẩn, từ đó lập kế hoạch và triển khai biện pháp phòng ngừa hiệu quả, hạn chế sai sót và sự cố.Nâng cao hiệu quả hệ thống quản lý chất lượng (QMS)
Giúp phát hiện nhanh các lỗi, thực hiện hành động khắc phục kịp thời, cải tiến quy trình và tối ưu hoạt động của phòng xét nghiệm.Tăng lợi thế cạnh tranh và uy tín thương hiệu
Chứng nhận ISO 15189 là bằng chứng về năng lực và cam kết chất lượng theo tiêu chuẩn quốc tế, giúp thu hút khách hàng và tạo lợi thế so với đối thủ chưa đạt chứng nhận.Cải thiện năng suất và hiệu quả hoạt động
Quy trình làm việc được chuẩn hóa và hợp lý hóa, giúp tiết kiệm thời gian, nguồn lực và nâng cao hiệu quả tổng thể.Nâng cao sự hài lòng của khách hàng
Dịch vụ xét nghiệm chính xác, kịp thời và đáng tin cậy sẽ gia tăng sự tin tưởng và mức độ hài lòng của khách hàng.
Nội Dung Các Yêu Cầu Chính Của Tiêu Chuẩn ISO 15189
SO 15189 là tiêu chuẩn quốc tế dành cho các phòng xét nghiệm y tế, giúp xây dựng hệ thống quản lý chất lượng, nâng cao năng lực chuyên môn và đảm bảo độ tin cậy của kết quả xét nghiệm. Phiên bản mới của tiêu chuẩn này chú trọng hơn đến quản lý rủi ro, yêu cầu đối với xét nghiệm tại chỗ (POCT) và đảm bảo sự tương thích với ISO 17025:2017.
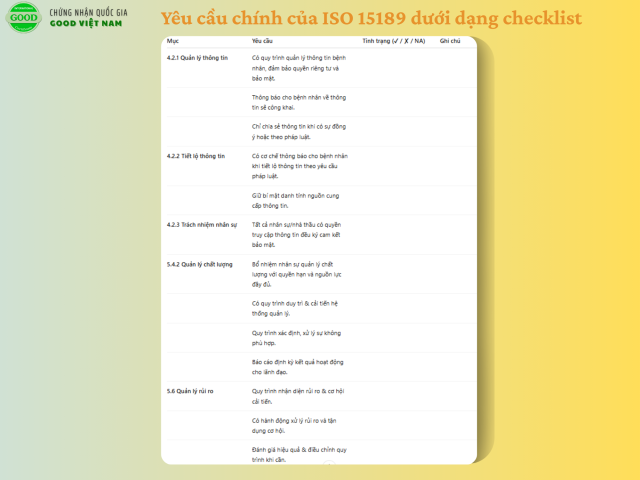
Bảo mật thông tin (Mục 4.2)
Phòng xét nghiệm phải chịu trách nhiệm về việc quản lý toàn bộ thông tin bệnh nhân, bao gồm dữ liệu thu thập hoặc tạo ra trong quá trình hoạt động. Thông tin này cần được bảo vệ để đảm bảo quyền riêng tư và tính bảo mật.
Việc công khai thông tin chỉ được thực hiện khi:
Có sự đồng ý của bệnh nhân hoặc người sử dụng dịch vụ;
Thông tin đã được bệnh nhân công khai;
Hoặc khi pháp luật yêu cầu.
Nếu phải tiết lộ thông tin theo quy định pháp luật hoặc thỏa thuận hợp đồng, phòng xét nghiệm cần thông báo cho bệnh nhân (trừ trường hợp pháp luật cấm). Ngoài ra, mọi cá nhân, kể cả nhân viên bên ngoài hay nhà thầu có quyền truy cập dữ liệu, đều phải tuân thủ nguyên tắc bảo mật.
Quản lý chất lượng (Phần 5.4.2)
Phòng xét nghiệm cần bổ nhiệm nhân sự quản lý chất lượng có đầy đủ quyền hạn và nguồn lực để thực hiện nhiệm vụ. Vai trò này bao gồm:
Duy trì và cải tiến hệ thống quản lý;
Phát hiện và xử lý sự không phù hợp;
Đề xuất hành động phòng ngừa/khắc phục;
Báo cáo cho lãnh đạo về hiệu quả hệ thống và nhu cầu cải tiến;
Đảm bảo mọi hoạt động của phòng xét nghiệm đạt hiệu quả.
Quản lý rủi ro (Phần 5.6)
Ban lãnh đạo phòng xét nghiệm phải xây dựng và duy trì các quy trình xác định rủi ro có thể gây hại cho bệnh nhân, đồng thời tìm ra cơ hội cải tiến chất lượng dịch vụ xét nghiệm. Các hành động xử lý rủi ro và tận dụng cơ hội cần được triển khai, đánh giá hiệu quả và điều chỉnh khi cần thiết.
Tiêu chuẩn cũng khuyến nghị tham khảo ISO 22367 để quản lý rủi ro trong phòng xét nghiệm y tế và ISO 35001 để quản lý rủi ro sinh học.
Xem thêm dịch vụ liên quan:
Quy Trình Áp Dụng Tiêu Chuẩn ISO 15189
Tiêu chuẩn ISO 15189 chỉ ra tầm quan trọng của sự tham gia của ban quản lý khi triển khai hệ thống quản lý chất lượng mới. Trước khi thực hiện bất kỳ thay đổi nào, người ta phải kiểm tra tất cả các yêu cầu để thực hiện đúng thủ tục và quy trình nhằm tuân thủ tiêu chuẩn.
Ban quản lý phòng thí nghiệm y tế có trách nhiệm và vai trò quan trọng khi lập kế hoạch, thực hiện và cải tiến liên tục các quy trình, bằng cách cung cấp:
- Các chính sách và hỗ trợ quản lý phù hợp;
- Vai trò và trách nhiệm phân phối trong công ty;
- Tất cả các nguồn lực cần thiết để tuân thủ tiêu chuẩn;
- Việc đào tạo đầy đủ phải nhất quán với việc triển khai QMS.
Việc triển khai QMS dựa trên ISO 15189 phụ thuộc vào một số yêu cầu. Dưới đây là một số trong số họ:
Yêu cầu về tổ chức:
- Xác định và áp dụng một chính sách chung cùng với các mục tiêu và chỉ số của nó;
- Hệ thống thông tin liên lạc với tất cả các bên liên quan (đặc biệt trong bối cảnh so sánh liên phòng thí nghiệm);
- Đào tạo nhân sự.
Yêu cầu quản lý rủi ro:
- Việc thực hiện các nguyên tắc đảm bảo chất lượng thông qua kiểm soát chung của tài liệu;
- Danh mục các thủ tục và phương pháp phân tích ;
- Phòng ngừa rủi ro ;
- Kiểm soát chất lượng;
- Kiểm toán nội bộ;
- Kế hoạch hành động toàn cầu.
Yêu cầu kỹ thuật:
- Quản lý vật tư, thiết bị, nhà xưởng ;
- Xem xét các khía cạnh môi trường (vật tư tiêu hao, chất thải, v.v.);
- Hệ thống máy tính phòng thí nghiệm .
Việc triển khai tiêu chuẩn ISO 15189 là một quy trình đầy đủ và hấp dẫn, đòi hỏi sự tham gia của tất cả những người vận hành và quy trình trong suốt vòng đời phân tích của phòng thí nghiệm cho dù trong ba quy trình kiểm tra: quy trình trước xét nghiệm (phân tích theo chỉ định và mẫu), quy trình quá trình kiểm tra và quá trình sau kiểm tra (báo cáo phân tích). Mỗi bước đều rất quan trọng để chăm sóc bệnh nhân tốt.
Tiêu Chuẩn ISO 15189 PDF
ISO-15189-2022-tieng-viet
VĂN PHÒNG CHỨNG NHẬN QUỐC GIA – GOOD VIỆT NAM
Trụ sở: Số 50B Mai Hắc Đế, P. Nguyên Du, Q. Hai Bà Trưng, Hà Nội
Hotline: 0945.001.005 – 024.2231.5555
E-mail: chungnhanquocgia.com@gmail.com – info@chungnhanquocgia.com
Website: chungnhanquocgia.com
VĂN PHÒNG HÀ NỘI | VĂN PHÒNG ĐÀ NẴNG | VĂN PHÒNG HỒ CHÍ MINH |
Tòa nhà HLT – Số 23 Ngõ 37/2 Dịch vọng, P. Dịch Vọng, Q. Cầu Giấy, Hà Nội | Số 73 Lý Thái Tông, P. Thanh Khê Tây, Q. Thanh Khê, Tp. Đà Nẵng | Tòa nhà PLS, 282 Chu Văn An, Phường 26, Bình Thạnh, TP.HCM |
- Báo giá chi phí cấp chứng nhận ISO 13485 trọn gói (2025) - 29/10/2025
- Báo giá chi phí cấp chứng nhận ISO 27001 trọn gói (2025) - 29/10/2025
- Báo giá chi phí cấp chứng nhận HACCP trọn gói (2025) - 29/10/2025